- Naturaleza de las superficies de interacción
- Interacciones que se establecen
- Motivos proteicos que rellenan el surco mayor del B-DNA
- Unión al surco menor con deformación del B-DNA
- Ejemplos: enzimas que sintetizan o modifican DNA
- Naturaleza de las superficies de interaccion. Las superficies de interacción de las proteínas son, en general, variadas. Desde el punto de vista de la estructura secundaria, las superficies de las proteínas están formadas por parte de las superficies de sus hélices α, láminas β y bucles que las conforman. Las superficies de las moléculas de DNA son menos variadas: la hélice de B-DNA presenta una superficie monótona en forma de “tornillo” con crestas de fosforibosa entre las que se forman dos surcos (mayor y menor). La diferencia entre distintas secuencias de nucleótidos sólo se aprecian desde fuera en el surco mayor, por donde asoman las bases. Las superficies de las moléculas de RNA que poseen estructura terciaria (como el t-RNA) son casi tan complejas como la de las proteínas.
- Interacciones que se establecen. Puentes de hidrógeno entre los residuos de aminoácidos cargados y polares y las bases nitrogenadas (son fundamentales para el reconocimiento específico de secuencias de DNA). Puentes de hidrógeno e interacciones electrostáticas entre los grupos fosfato y residuos de aminoácidos cargados o extremos N-terminales de hélices α. Interacciones de van der Waals y efecto hidrófobo.
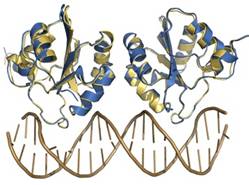
- Motivos proteicos que rellenan el surco mayor del B-DNA. Al ser el surco mayor el único sitio donde las bases son accesibles desde el exterior del B-DNA sin distorsionarlo, el surco mayor constituye el principal sitio de reconocimiento. Como la interacción entre moléculas es más fuerte si sus superficies son complementarias, la interacción proteína-DNA suele producirse rellenando el surco mayor.
- Relleno mediante hélices alfa: Es la forma más habitual. El surco mayor tiene 12 Å de diámetro y 7 de profundidad. La hélice alfa (incluidas las cadenas laterales) tiene un diámetro promedio de 12Å y resulta ideal para rellenarlo. Los motivos principales son los siguientes:
- Hélice-giro-helice: Es frecuente en represores y activadores de la transcripción del DNA procariota. También aparece en proteínas que controlan el desarrollo en insectos y vertebrados.
- Dedo de Zn++: Presente en todos los eucariotas desde levaduras hasta personas. Incluye la secuencia consenso: X3-C-X2-4-C-X12-H-X3-4-H-X4. Las proteínas que los contienen suele presentar varios dedos de cinc y se unen al DNA en varios puntos.
- Cremalleras de leucina: arrollamiento de dos hélices alfa estabilizado por contactos de van der Waals y efecto hidrófobo. Las secuencias de las hélices presentan una leucina cada 7 residuos.
- Relleno mediante lámina β de dos hebras: Una lámina β de dos hebras tiene un diámetro semejante a una hélice alfa y también puede rellenar el surco mayor del B-DNA y reconocer las bases que asoman.
- Relleno mediante bucles: Obviamente también un bucle puede presentar el diámetro adecuado y hay ejemplos de proteínas que reconocen B-DNA introduciendo un bucle en el surco mayor.
- Relleno mediante hélices alfa: Es la forma más habitual. El surco mayor tiene 12 Å de diámetro y 7 de profundidad. La hélice alfa (incluidas las cadenas laterales) tiene un diámetro promedio de 12Å y resulta ideal para rellenarlo. Los motivos principales son los siguientes:
- Unión al surco menor con deformacion del B-DNA. El reconocimiento específico de secuencias de DNA a través del surco menor requiere su distorsión para acceder a las bases. A menudo algún residuo de la proteína (por ej: una prolina) ser intercala entre las bases para romper su apareamiento y esto provoca una fuerte torsión en el DNA.
- Ejemplos: enzimas que sintetizan o modifican DNA: aminoacil t-RNA sintetasas. Las enzimas que sintetizan o modifican DNA suelen establecer contactos extensos que, a menudo determinan que la molécula de DNA queda rodeada por la proteína en la región de interacción. Así por ejemplo: subunidad beta de la DNA polimerasa III, girasa, topoisomerasa, enzimas de restricción: PvuII, EcoRV.